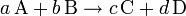
- A, B, C, D, representan los símbolos químicos de las moléculas o átomos que reaccionan (lado izquierdo) y los que se producen (lado derecho).
- a, b, c, d, representan los coeficientes estequiométricos, que deben ser ajustados de manera que sean reflejo de la ley de conservación de la masa.
Así, se diría de la ecuación de geometría esteqiometrica se subdivide en la siguiente:
1. Cuando "a" átomos (o moléculas) de A reaccionan con "b" átomos (o moléculas) de B producen "c" átomos (o moléculas) de C, y "d" átomos (o moléculas) de D.
2. Cuando "a" moles de átomos (o moléculas) de A reaccionan con "b" moles de átomos (o moléculas) de B producen "c" moles de átomos (o moléculas) de C, y "d" moles de átomos (o moléculas) de D.
Por ejemplo el hidrógeno (H2) puede reaccionar con oxígeno (O2) para dar agua (H2O). La ecuación química para esta reacción se escribe:
El símbolo "+" se lee como "reacciona con", mientras que el símbolo "→" significa "irreversible" o "produce". Para ajustar la ecuación, ponemos los coeficientes estequiométricos.
La ecuación está ajustada y puede ser interpretada como 2 mol de moléculas de hidrógeno reaccionan con 1 mol de moléculas de oxígeno, produciendo 2 mol de moléculas de agua.
Las fórmulas químicas a la izquierda de "→" representan las sustancias de partida, denominadas reactivos o reactantes; a la derecha de "→" están las fórmulas químicas de las sustancias producidas, denominadas productos.
Los números delante de las fórmulas son llamados coeficientes estequiométricos. Estos deben ser tales que la ecuación química esté balanceada, Es decir, que el número de átomos de cada elemento de un lado y del otro sea el mismo. Los coeficientes deben ser enteros positivos, y el uno se omite. En las únicas reacciones que esto no se produce, es en las reacciones nucleares.
Adicionalmente, se pueden agregar (entre paréntesis y como subíndice) el estado de cada sustancia participante: sólido (S), líquido (l), acuoso (Ac) O gaseoso (g).
En el ejemplo del agua:


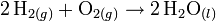
No hay comentarios:
Publicar un comentario