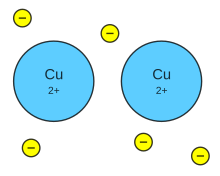
A + B C + D
Reactivos Productos
Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. En todos el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia.
Balanceo de ecuaciones por el método de Tanteo
El método de tanteo consiste en observar que cada miembro de la ecuación se tengan los átomos en la misma cantidad, recordando que en
Para equilibrar ecuaciones, solo se agregan coeficientes a las formulas que lo necesiten, pero no se cambian los subíndices.
Ejemplo: Balancear la siguiente ecuación
H2O + N2O5 NHO3
H2O + N2O5 2 NHO3
Otros ejemplos
HCl + Zn ZnCl2 H2
2HCl + Zn ZnCl2 H2
KClO3 KCl + O2
2 KClO3 2KCl + 3O2
Balanceo de ecuaciones por el método de Redox ( Oxidoreduccion )
En una reacción si un elemento se oxida, también debe existir un elemento que se reduce. Recordar que una reacción de oxido reducción no es otra cosa que una perdida y ganancia de electrones, es decir, desprendimiento o absorción de energía (presencia de luz, calor, electricidad, etc.)
Para balancear una reacción por este método , se deben considerar los siguiente pasos
1)Determinar los números de oxidación de los diferentes compuestos que existen en la ecuación.
Para determinar los números de oxidación de una sustancia, se tendrá en cuenta lo siguiente:
2) Una vez determinados los números de oxidación , se analiza elemento por elemento, comparando el primer miembro de la ecuación con el segundo, para ver que elemento químico cambia sus números de oxidación
0 0 +3 -2
Fe + O2 Fe2O3
Los elementos que cambian su numero de oxidación son el Fierro y el Oxigeno, ya que el Oxigeno pasa de 0 a -2 Y el Fierro de 0 a +3
3) se comparan los números de los elementos que variaron, en la escala de Oxido-reducción
0 0 +3 -2
Fe + O2 Fe2O3
El fierro oxida en 3 y el Oxigeno reduce en 24) Si el elemento que se oxida o se reduce tiene numero de oxidación 0 , se multiplican los números oxidados o reducidos por el subíndice del elemento que tenga numero de oxidación 0
Fierro se oxida en 3 x 1 = 3
Oxigeno se reduce en 2 x 2 = 4
5) Los números que resultaron se cruzan, es decir el numero del elemento que se oxido se pone al que se reduce y viceversa4Fe + 3O2 2Fe2O3
Los números obtenidos finalmente se ponen como coeficientes en el miembro de la ecuación que tenga mas términos y de ahí se continua balanceando la ecuación por el método de tanteoOtros ejemplos
KClO3 KCl + O2
+1 +5 -2 +1 -1 0KClO3 KCl + O2
Cl reduce en 6 x 1 = 6
O Oxida en 2 x 1 = 2
2KClO3 2KCl + 6O2
Cu + HNO3 NO2 + H2O + Cu(NO3)2
0 +1 +5 -2 +4 -2 +2 -2 +2 +5 -2
Cu + HNO3 NO2 + H2O + Cu(NO3)2
Cu oxida en 2 x 1 = 2
N reduce en 1 x 1 = 1
Cu + HNO3 2NO2 + H2O + Cu(NO3)2
Cu + 4HNO3 2NO2 + 2H2O + Cu(NO3)2
Balanceo de ecuaciones por el método algebraico
Este método esta basado en la aplicación del álgebra. Para balancear ecuaciones se deben considerar los siguientes puntos
1) A cada formula de la ecuación se le asigna una literal y a la flecha de reacción el signo de igual. Ejemplo:
Fe + O2 Fe2O3
A B C2) Para cada elemento químico de la ecuación, se plantea una ecuación algebraica
Para el Fierro A = 2C
Para el Oxigeno 2B = 3C
3) Este método permite asignarle un valor (el que uno desee) a la letra que aparece en la mayoría de las ecuaciones algebraicas, en este caso la C
Por lo tanto si C = 2
Si resolvemos la primera ecuación algebraica, tendremos:
2B = 3C
2B = 3(2)
B = 6/2
B = 3
Los resultados obtenidos por este método algebraico son
A = 4
B = 3
C = 2
Estos valores los escribimos como coeficientes en las formulas que les corresponden a cada literal de la ecuación química, quedando balanceada la ecuación4Fe + 3O2 2 Fe2O3


 de un aminoácido, péptido, polipéptido o proteína con otro.
de un aminoácido, péptido, polipéptido o proteína con otro.